Содержание
+7 (812) 701-02-14 Круглосуточно
Интересен тот факт, что АДППК у кошек имеет много сходных черт с аналогичным заболеванием у человека, и этот вид животных признан исследователями как идеальная модель для изучения и разработки методов лечения этой тяжёлой патологии у людей.
Поликистоз почек встречается также у собак и многих других видов животных.
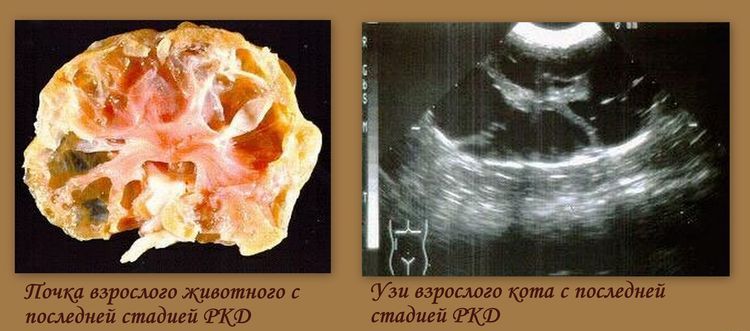
АДППК характеризуется медленно прогрессирующим течением с неуклонным ростом множественных, обычно заполненных жидкостью или рыхлой бесформенной массой, кист в паренхиме обеих почек, замещающих её нормальные структуры. Следует отметить, что если у пациента несколько кист визуализируются только в одной почке, то процесс их образования скорее всего имеет иную, не генетическую этиологию.
Кисты при АДППК у котят, как правило, приблизительно одинакового размера, а у взрослых кошек могут сильно различаться по форме и величине, иногда достигая весьма значительных размеров. Изнутри кисты выстланы эпителием, происходящим из клеток почечных канальцев и собирательных трубочек, однако менее дифференцированным. На начальном этапе заболевания кистозные перерождения соседствуют с участками неизменённой почечной паренхимы.
Заболевание часто заканчивается развитием хронической почечной недостаточности (ХПН) и гибелью пациентов от её последствий в терминальную стадию. Появление клинических признаков ХПН, связанных с АДППК, как правило, развивается у пациентов 3–10-летнего возраста, хотя и возможны значительные отклонения как в большую, так и меньшую стороны.
Так, например, известны случаи смерти 6–7-месячных котят от ХПН, вызванной поликистозом почек. Напротив, у некоторых животных клинические проявления поликистоза не возникали даже в возрасте старше 10–15 лет, а обнаружение характерных изменений в почках являлось случайной находкой при УЗИ, проведённом по другим, не связанным с нефропатиями, причинам. Такое положение дел связано с варьирующей экспрессивностью гена PKD 1 , которая может приводить к выраженной вариабельности течения заболевания даже у особей с одинаковым генотипом. Поэтому одной из серьёзных проблем, связанной с АДППК, является на сегодня то, что изначально невозможно спрогнозировать, какое животное, имеющее положительный тест на PKD 1 , погибнет в раннем возрасте, а у какого развитие заболевания пойдёт по пути медленного прогресса. Почечные кисты у кошек являются результатом деформации и видоизменения канальцев всех типов нефронов и начинают образовываться как в корковом, так и мозговом веществе почек. Процесс кистообразования хотя и протекает с различной скоростью у разных животных, но неуклонно прогрессирует в течение всей жизни пациента и очень часто приводит к нефромегалии, сопровождающейся бугристостью почек, обычно легко диагностируемой при пальпации. Кисты могут сообщаться с просветом отдельных участков нефронов, кровеносными сосудами и лоханкой. У некоторых пациентов АДППК сочетается также с образованием кист в матке, поджелудочной железе и селезёнке (т.е. заболевание может приобретать вид системной патологии). Чаще других изменения диагностируются в печени, поражение которой обычно характеризуется расширением и склерозированием мелких и средних желчных протоков. Распространённость поликистоза почек в популяциях кошек в мире Наиболее подвержены АДППК персидские кошки (так, например, до 38% персидских кошек во всём мире поражены АДППК) и породы, выведенные с их участием.
ДИАГНОСТИКА
АДППК Впервые поликистоз почек был описан в 1967 году в университете штата Огайо у шестилетней персидской кошки. Но повышенный интерес к заболеванию возник у заводчиков, селекционеров и ветеринарных специалистов только в 90-х годах ХХ века. Этой проблеме полностью были посвящены несколько международных семинаров, и до сих пор АДППК продолжает оставаться обсуждаемой темой на различных ветеринарных конгрессах во всём мире. Длительное время единственным методом диагностики (визуализации) АДППК было УЗИ почек. Этот метод прост в исполнении и до сих пор очень широко используется в рутинной врачебной работе для скрининга АДППК в популяциях клинически здоровых кошек (именно поэтому УЗИ является неотъемлемой частью комплексного нефрологического обследования и должно проводиться у всех животных с подозрениями на нефропатии). Выявить ярко выраженные структурные изменения при УЗИ, как правило, удаётся у животных старше 3–8-месячного возраста.
Однако в апреле 2005 года был предложен, а затем и широко внедрён в клиническую практику лабораторный метод диагностики этой патологии. Новый подход значительно облегчил скрининг заболевания и на сегодняшний день позволяет выявлять его в популяции кошек на значительно более ранних этапах, чем это можно делать с помощью УЗИ, например, у котят чуть старше месячного возраста. Научная основа генетического метода выявления АДППК следующая. Точечная мутация (трансверсия C—>A) в экзоне3 29 гена, названного PKD 1 (polycystic kidney disease 1 (autosomal dominant)), как доказано, является обязательным условием для развития поликистоза почек у кошек. Поэтому выявление или, напротив, невыявление этой т.н. молекулярной диагностической единицы с помощью лабораторных методов диагностики (например, ПЦР) на сегодняшний день и стало доступным, а в некоторых странах и рутинным методом диагностики АДППК. Анализ для отправки в авторитетную лабораторию берётся у пациента обычно путём взятия мазка из ротовой полости. А в случае котят, сосущих молоко, в составе которого находятся гены матери, способные повлиять на достоверность анализа, а также у возрастных животных для проведения точного анализа необходима кровь из вены. Достоверность диагностики этими методами на сегодняшний день составляет 98-99,9%.
Проведение теста на АДППК, равно как и на вирусную лейкемию и вирусный иммунодефицит, является обязательным исследованием перед продажей и вязкой кошек (прежде всего попадающих в группу риска по породной принадлежности). И особенно важно это в случае племенных животных. В некоторых странах (ЕС, США) существуют общедоступные базы данных с результатами исследования на АДППК. Информация, полученная при диагностическом исследовании, записывается в лицензированном ветеринарном учреждении на микрочип животного, а данные передаются в AD-PKD Negative Register.
Для диагностики АДППК нежелательно использование выделительной урографии из-за риска реализации нефротоксичных эффектов рентгеноконтрастных веществ и угрозы значимого ухудшения почечной функции. Кроме того, контрастное вещество может депонироваться в почечных кистах и длительное время оказывать своё негативное влияние, в том числе и на неизменённую почечную ткань. Ретроградная же урография при поликистозе почек вообще противопоказана. Также следует помнить, что наличие полостей в почке является категорическим противопоказанием к проведению пункционной и аспирационной биопсии. Кроме того, сами эти методы при поликистозе почек неоправданны (не информативны) с диагностической точки зрения.
Интересной особенностью течения доклинического этапа АДППК является то, что уровень эритропоэтина (из-за гиперпродукции его мозговым слоем почек) и, соответственно, Hb у больных животных значительно повышается. Поэтому полицитемия (появление в крови избыточного количества эритроцитов) может служить одним из косвенных признаков этого заболевания. На клиническом этапе эти показатели хотя и снижаются, но их величина никак не коррелирует с тяжестью структурных изменений в почечной паренхиме. Напротив, при диабетической нефропатии уровень эритропоэтина у пациентов, как правило, значительно ниже того, который можно было бы ожидать, исходя из результатов лабораторных и визуальных методов диагностики.
КЛИНИЧЕСКИЕ СИМПТОМЫ
АДППК Клинические проявления АДППК ничем не отличаются от таковых при ХБП, вызванной любой другой причиной, и не характеризуются какой-либо патогномоничностью. Исключением, как правило, на заключительных этапах течени ААДППК, могут быть названы только характерные изменения размеров, структуры и контура почек, легко выявляемые при пальпации. По большому счёту АДППК — это вариант ХБП с установленной первичной этиопатологической причиной, неотъемлемым маркером и фактором патогенеза которой является определённая генетическая патология.
Поэтому в ветеринарной документации в разделе «окончательный диагноз» сначала отмечают АДППК, а затем — ХБП с указанием (по классификации IRIS) степени ХПН по уровню креатинина, величины суточной протеинурии (по соотношению P/C U) и системной гипертензии.
АДППК является одним из классических примеров того, что для диагностики заболеваний почек ни в коем случае нельзя опираться только на уровень креатинина сыворотки крови. У животного с поликистозом его нормальный уровень может длительное время сохраняться (равно как и могут отсутствовать любые другие признаки нефропатии), но это никоим образом не говорит о том, что у пациента нет неизлечимой и смертельно опасной патологии.
Для АДППК характерны следующие изменения в результатах исследования биологических жидкостей, возникающие ещё на доклиническом этапе течения почечного континуума:
• снижение относительной плотности мочи (< 1030) и развитие полиурии, наиболее раннее проявление заболевания, свидетельствующее об ущемлении концентрационной функции почек вследствие атрофии и фиброза, преимущественно тубулоинтерстиция;
• микрогематурия наблюдается довольно часто и является следствием истончения и разрыва сосудов в стенках кист, в том числе в результате АГ; макрогематурия может возникнуть в основном при стрессовых состояниях, травмах или при осложнении поликистоза почечно- или мочекаменной болезнью;
•протеинурия, как правило, не достигает высоких значений (в пределах 0,3 г/л); но неуклонное её возрастание в течение короткого времени свидетельствует о высоком риске прогрессирования ХПН, ассоциированной с АДППК, поскольку, как и при любой другой форме ХБП, протеинурия — это не только маркёр, но и значимый фактор поражения почечной паренхимы (прежде всего тубуло-интерстициального аппарата). Следует отметить, что все перечисленные изменения появляются намного раньше, чем у пациента развиваются какие-либо изменения в анализах крови.
Артериальная гипертензия (АГ) присутствует у большинства пациентов с АДППК ещё до развития у них клинических признаков ХПН и неуклонно прогрессирует с возрастом. Поскольку точное измерение давления крови у кошек связано с целым рядом трудностей, наиболее точным маркером хронизации гипертонической болезни служит патологический билатеральный мидриаз и напрямую связанные с ним характерные изменения на глазном дне (кровоизлияния в сетчатку, отслоение сетчатки, синдром извитых сосудов и «бычьих рогов» и т.д.).
Причиной развития АГ при АДППК служит гиперактивация ренин-ангиотензин-альдостероновой системы (РААС), возникающая в результате давления кист на сосуды почек и прежде всего на её первичную микрокапиллярную сеть (афферентные, эфферентные артериолы и капиллярные петли гломерулы). Гиперактивация РААС связана преимущественно с увеличением выработки ренина почками, в том числе и в атипичных для этого местах их паренхимы (в норме ренин вырабатывается только клетками юкстагломерулярного аппарата в стенках афферентных артериол клубочка в ответ на снижение кровяного давления и скорости клубочковой фильтрации). Ишемический компонент усугубляется другим звеном патогенеза АГ — задержкой натрия в организме, обусловленной генетически детерминированным увеличением его реабсорбции. Итогом гиперактивации как тканевого, так и плазменного компонентов РААС и прогрессирования АГ при АДППК является поражение других органов-мишеней и прежде всего сердца.
Кардиальная дисфункция в свою очередь усугубляет тяжесть АГ, что приводит к ещё большему поражению функционирующей почечной паренхимы. В итоге классический порочный круг ренально-кардиального и кардио-ренального синдромов замыкается.
Нефролитиаз может осложнять течение АДППК. Причинами повышенного образования мочевых камней обычно является нарушение в метаболизме и пассаже мочи по канальцам и собирательным трубочкам, а также застой содержимого в кистах.
Боль в брюшной полости, связанная с растяжением кистами капсулы почки и являющаяся частым клиническим признаком поликистоза почек у человека, не характерна для кошек. Поэтому использование обезболивающих препаратов при АДППК (особенно НПВП) является не только не рациональным, но и может значительно ухудшить почечную функцию из-за нефротоксичности, всем им присущей.
Клинические проявления АДППК появляются у животных только тогда, когда в состоянии деструкции оказывается не менее 75% ренальной паренхимы. Это характерно для ХБП в целом и связано с колоссальными компенсаторными возможностями почек.
Поэтому, также как и при любом другом варианте ХБП, в течении АДППК выделяют доклинический (как правило, занимающий до 75-90% времени заболевания) и клинический (причем не обязательно азотемический) этапы почечного континуума.
ЛЕЧЕНИЕ
Лечения АДППК На сегодняшний день нет ни одного известного способа, позволяющего замедлить генетически обусловленный темп роста почечных кист. Также они не могут быть иссечены хирургическим путем. Ведётся дискуссия по поводу целесообразности декапсуляции почек при АДППК на заключительных его этапах, но убедительных доказательств эффективности этого мероприятия пока не получено. Также вызывает сомнения методика, предполагающая эвакуацию жидкости из кист с последующим введением туда растворов этилового спирта. Но, разумеется, владельцев кошек, у которых, особенно в молодом возрасте, был диагностирован АДПП, интересует вопрос, можно ли отдалить время развития у их питомца клинических проявлений заболевания и смерти от терминальной стадии ХПН. Да, определённые терапевтические тактики ведения пациентов с АДППК существуют. Причём следует отметить, что начинать агрессивную нефропротективную терапию следует на доклиническом этапе почечного континуума как можно в более ранние сроки. Только такой подход позволит максимально продлить продолжительность полноценной жизни пациента.
В медицине человека получены убедительные доказательства того, что размер и количество кист не определяют темп снижения почечной функции. А декомпрессия кист не только не предотвращает прогрессирование ХПН при АДППК, но и не приводит к снижению уровня АГ. Прогрессирование ПН при поликистозе определяется прежде всего состоянием не изменённой кистами почечной ткани и напрямую зависит от темпа происходящих в ней склеротических изменений и скорости течения апоптоза. Кроме того, важную роль в ухудшении почечной функции играет АГ. Течение всех перечисленных процессов невозможно без гиперактивации РААС. Ключевой её нейрогормон — АГ II обладает не только выраженными вазоконстрикционными свойствами и приводит к повышению системного давления, но и инициирует и поддерживает процессы клеточной пролиферации (в том числе кардиомиоцитов и резидентных клеток клубочка) и склерозирования. Поэтому важнейшими терапевтическими задачами на доклиническом этапе течения АДППК будет снижение уровня АГ и контроль гиперактивности РААС. И успешное их решение может помочь улучшить прогноз заболевания в целом и отдалить клинический этап почечного континуума в частности. Из препаратов, контролирующих активность РААС на доклиническом этапе течения АДППК, возможно использование ингибиторов ангиотензин-превращающего фермента (иАПФ) и блокаторов рецепторов АГ II в средних терапевтических дозах, а также прямых ингибиторов ренина (Алискирен (Расилез, Риксила, табл. 150 и 300 мг); в дозе 4,5-9,5 мг/кг один раз в сутки длительно) или их сочетаний. На клиническом этапе из-за того, что подавляющее число нефропротективных препаратов начинают приобретать выраженные нефротоксичные свойства (из-за элиминации и/ или метаболизма почками), предпочтение отдается БРА телмисартану (Микардис, Прайтор, Semintra) в дозе 1–2 мг/кг один раз в день. Этот препарат не только способен эффективно контролировать активность вазоконстрикционного, пролиферативного и антидиуретического звеньев РААС (на вазодилатирующее, антипролиферативное и диуритические звенья РААС, в отличие от иАПФ, БРА не влияют), но и практически на 100% элиминируется из организма печенью. Последнее снижает его нефротоксичность, делает более предсказуемой фармакодинамику и фармакокинетику у пациентов с нефропатиями и позволяет его использовать даже у животных с тяжёлыми степенями ХПН.
Для контроля у пациентов с АДППК уровня АГ целесообразно назначение блокаторов кальциевых каналов. У кошек препаратом с доказанными гипотензивными свойствами является амлодипин (0,625 мг, а в случае стойкой или выраженной гипертенизии — 1,25 мг на кошку в сутки длительно). Хотя недигидропиридиновые представители этой группы (верапамил, дилтиазем) в дополнение к антигипертензивным свойствам обладают, по крайней мере с теоретической точки зрения, ещё и выраженными нефропротективными свойствами, значительно возрастающими при сочетанном их использовании с иАПФ и БРА.
В качестве препаратов второго ряда для лечения АГ при АДППК возможно назначение селективных адреноблокаторов (атенолол и метопролол: внутрь 1–2 мг/кг массы тела 1–2 раза в сутки длительно). Перспективным для использования представляется также кардиоселективный липофильный адреноблокатор III поколения с вазодилатирующими и антиангиальными свойствами — небиволол. Нужно учитывать, что верапамил не следует назначать с адреноблокаторами из-за взаимного усиления побочных эффектов (например, развития выраженной брадиаритмии). В остальном БКК, адреноблокаторы и препараты, контролирующие гиперактивность РААС, взаимно дополняют эффекты друг друга. Также их сочетанное использование позволяет минимум в два раза снижать дозу каждого конкретного препарата и тем самым нивелировать часть присущих ему побочных эффектов.
Основанием для отмены препаратов, контролирующих гиперактивность РААС и уровень АГ (за исключением, возможно, телмисартана), является повышение уровня креатинина, калия и/или появление клинических признаков ХПН.
Контроль гиперфосфатемии и её необратимого последствия — гиперпаратиреоза (а гиперплазия паращитовидных желез, как известно, необратима и всегда приводит к стойкому повышению уровня паратиреоидного гормона (ПТГ) в организме) — также необходимо начинать на доклиническом этапе течения АДППК. Для этого следует рекомендовать пациентам как диетические продукты с низким содержанием фосфора, так и фосфат-байндеры (карбонат кальция + хитозан, лантаренол и т.д.). Сложностью в контроле гиперфосфатемии является то, что у больных животных длительное время уровень фосфора может быть компенсирован повышенным уровнем ПТГ, способным длительное время форсировать выделение этого элемента из организма даже на фоне выраженного ущемления почечной функции (этот промежуток времени называется компенсированной гиперфосфатемией). Когда же и этот компенсаторный механизм перестаёт справляться со своей задачей, то уровень фосфатемии начинает стремительно нарастать. Кроме того, в последующем, на фоне гиперплазии паращитовидной железы, даже низкий уровень фосфора не приведёт к уменьшению её гиперактивности. Определение же уровня самого ПТГ представляет в ветеринарной медицине (во всяком случае в России) большие сложности из-за невозможности использования человеческих реактивов. Поэтому уровень фосфора у животных с АДПП на доклинических этапах почечного континуума желательно поддерживать на нижних границах референсных значений. Только такой подход позволит отдалить накопление в организме одного из самых значимых уремических токсинов — паратиреоидного гормона.
Диуретики, в том числе петлевые, не снижают уровень АГ у животных с АДПП (в этом отношении их эффект невелик у животных и при АГ другого генеза). Кроме того, они (особенно петлевые и тиазидные) противопоказаны в связи с вероятностью усугубления нарушения транспорта натрия в канальцах и усиления тяжести полицитемии.
Длительное назначение НПВП (даже современных селективных ингибиторов ЦОГ-2) для купирования болевого синдрома любого генеза у животных с поликистозом почек противопоказано, поскольку способно привести к усугублению поражения тубулоинтерстиция и стремительному снижению почечной функции. Инфицирование содержимого кист патогенами является довольно редким осложнением при АДППК и возможно в большинстве случаев только лимфо-гематогенным путём на фоне выраженных иммунодефицитных состояний (например, при тяжело протекающих вирусных инфекциях). Диагностика данного осложнения в обязательном порядке требует проведения бакпосева мочи, полученной чрезбрюшинным уроцистоцинтезом или, в некоторых случаях, непосредственно из кист. Большой сложностью при лечении инфицированных кист является то, что антибиотики должны свободно в них проникать и затем накапливаться внутри. Этой способностью обладают только высоколипофильные антибактериальные препараты, например ципрофлоксацин. Вместе с тем большинство других антибиотиков, например, пенициллины и аминогликозиды, с трудом проникают в кисты, и поэтому назначение их нерационально, а в случае последних ещё и противопоказано из-за выраженных нефротоксичных свойств.
На клиническом этапе течения АДППК, т.е. у животных со значительно сниженной почечной функцией, возможна (как и при ХБП, имеющей любую другую этиологию) только заместительная и/или симптоматическая терапия (описание которой не является целью данной статьи, а сами рекомендации по этой теме без труда можно обнаружить в доступной литературе). Уже по определению эта терапия далеко не всегда способна значимо улучшить качество жизни пациентов, даже при значительных затратах времени и материальных средств со стороны владельцев, поскольку приходится бороться с дисфункцией органа, выполняющего колоссальное число разнообразных экскреторных, инкреторных, метаболических и эндокринных функций. Кроме того, проведение интенсивных лечебных мероприятий часто приводит к развитию у кошек острого или хронического стресса, способного нивелировать усилия врачей даже в случае куда менее тяжёлых патологий, чем АДПП. Следует отметить, что в гуманной медицине доказано, что, например, контроль гипертонии, начатый на фоне уже значительно сниженной почечной функции, не приводит к замедлению скорости прогрессирования ХПН, ассоциированной с АДПП человека. В некоторых случаях у животных с АДПП для лечения болевого синдрома и/или хронического стресса, связанного с проведением лечебных мероприятий, целесообразно использование трициклических антидепрессантов, таких как амитриптилин, имипрамин или кломипрамин. Вид препарата, а также его доза и продолжительность использования подбираются индивидуально в зависимости от потребностей и индивидуальной чувствительности пациента.
ПРОГНОЗ
Прогноз у животных, больных поликистозом почек, определяется темпом прогрессирования ХПН, который может быть особенно велик у кошек:
• первые клинические проявления заболевания у которых появились в молодом возрасте;
• имеющих в анамнезе неконтролируемую АГ, эпизоды макрогематурии и рецидивирующие (хронические) бактериальные инфекции МВС;
Роман Леонард, президент Российской научно-практической ассоциации ветеринарных нефрологов и урологов (www.vetnefro.ru), руководитель Уральского центра ветеринарной нефрологии и урологии, г. Челябинск. E-mail: vetnefro@mail.ru
Введение
Аутосомно-доминантный поликистоз почек кошек (АДППК)1 является самой распространённой генетически детерминированной патологией у этого вида животных во всём мире. Сам тип наследования заболевания — простой аутосомно-доминантный — говорит о том, что необратимые патологические изменения вызывает всего один, находящийся в аутосоме2, мутантный доминантный ген PKD13. Поэтому его присутствие у любого из родителей способно привести к патологии у потомков вне зависимости от их пола. А на 100% здоровое потомство можно рассчитывать только от двух PKD1-негативных родителей.
Интересен тот факт, что АДППК у кошек имеет много сходных черт с аналогичным заболеванием у человека, и этот вид животных признан исследователями как идеальная модель для изучения и разработки методов лечения этой тяжёлой патологии у людей. Поликистоз почек встречается также у собак и многих других видов животных.
АДППК характеризуется медленно прогрессирующим течением с неуклонным ростом множественных, обычно заполненных жидкостью или рыхлой бесформенной массой, кист в паренхиме обеих почек, замещающих её нормальные структуры. Следует отметить, что если у пациента несколько кист визуализируются только в одной почке, то процесс их образования скорее всего имеет иную, не генетическую этиологию.
Кисты при АДППК у котят, как правило, приблизительно одинакового размера, а у взрослых кошек могут сильно различаться по форме и величине, иногда достигая весьма значительных размеров. Изнутри кисты выстланы эпителием, происходящим из клеток почечных канальцев и собирательных трубочек, однако менее дифференцированным. На начальном этапе заболевания кистозные перерождения соседствуют с участками неизменённой почечной паренхимы.
Заболевание часто заканчивается развитием хронической почечной недостаточности (ХПН) и гибелью пациентов от её последствий в терминальную стадию. Появление клинических признаков ХПН, связанных с АДППК, как правило, развивается у пациентов 3–10-летнего возраста, хотя и возможны значительные отклонения как в большую, так и меньшую сторону. Так, например, известны случаи смерти 6–7-месячных котят от ХПН, вызванной поликистозом почек. Напротив, у некоторых животных клинические проявления поликистоза не возникали даже в возрасте старше 10–15 лет, а обнаружение характерных изменений в почках являлось случайной находкой при УЗИ, проведённом по другим, не связанным с нефропатиями, причинам.
Такое положение дел связано с варьирующей экспрессивностью гена PKD1, которая может приводить к выраженной вариабельности течения заболевания даже у особей с одинаковым генотипом. Поэтому одной из серьёзных проблем, связанной с АДППК, является на сегодня то, что изначально невозможно спрогнозировать, какое животное, имеющее положительный тест на PKD1, погибнет в раннем возрасте, а у какого развитие заболевания пойдёт по пути медленного прогресса.
Почечные кисты у кошек являются результатом деформации и видоизменения канальцев всех типов нефронов и начинают образовываться как в корковом, так и мозговом веществе почек . Процесс кистообразования хотя и протекает с различной скоростью у разных животных, но неуклонно прогрессирует в течение всей жизни пациента и очень часто приводит к нефромегалии, сопровождающейся бугристостью почек, обычно легко диагностируемой при пальпации. Кисты могут сообщаться с просветом отдельных участков нефронов, кровеносными сосудами и лоханкой. У некоторых пациентов АДППК сочетается также с образованием кист в матке, поджелудочной железе и селезёнке (т.е. заболевание может приобретать вид системной патологии). Чаще других изменения диагностируются в печени, поражение которой обычно характеризуется расширением и склерозированием мелких и средних желчных протоков.
Распространённость поликистоза почек в популяциях кошек в мире
Наиболее подвержены АДППК персидские кошки (так, например, до 38% персидских кошек во всём мире поражены АДППК) и породы, выведенные с их участием (таблица 1).
Таблица 1. Породы кошек с высоким, средним и низким уровнем вероятности развития АДППК
|
Породы с высоким риском развития АДППК |
Породы с умеренным риском развития АДППК |
Породы с низким риском развития АДППК |
|
Персидская |
Бомбей |
Абиссинская |
|
Экзотическая короткошёрстная |
Азиатская |
Ангорская |
|
Британская короткошёрстная |
Бурмилла |
Балинезийская |
|
Тиффани |
Бенгальская |
|
|
Священная бирма |
Бирманская |
|
|
Корниш-рекс |
Египетская мау |
|
|
Девон-рекс |
Корат |
|
|
Регдолл |
Мейн-кун |
|
|
Сноу-шу |
Норвежская лесная |
|
|
Оцикет |
||
|
Ориентальная длинношёрстная |
||
|
Ориентальная короткошёрстная |
||
|
Русская голубая |
||
|
Сиамская |
||
|
Сингапурская |
||
|
Сомалийская |
||
|
Тонкинезская |
||
|
Турецкий ван |
Диагностика АДППК
Впервые поликистоз почек был описан в 1967 году в университете штата Огайо у шестилетней персидской кошки. Но повышенный интерес к заболеванию возник у заводчиков, селекционеров и ветеринарных специалистов только в 90-х годах ХХ века. Этой проблеме полностью были посвящены несколько международных семинаров, и до сих пор АДППК продолжает оставаться обсуждаемой темой на различных ветеринарных конгрессах во всём мире.
Длительное время единственным методом диагностики (визуализации) АДППК было УЗИ почек. Этот метод прост в исполнении и до сих пор очень широко используется в рутинной врачебной работе для скрининга АДППК в популяциях клинически здоровых кошек (именно поэтому УЗИ является неотъемлемой частью комплексного нефрологического обследования и должно проводиться у всех животных с подозрениями на нефропатии4). Выявить ярко выраженные структурные изменения при УЗИ, как правило, удаётся у животных старше 3–8-месячного возраста.
Однако в апреле 2005 года был предложен, а затем и широко внедрён в клиническую практику лабораторный метод диагностики этой патологии. Новый подход значительно облегчил скрининг заболевания и на сегодняшний день позволяет выявлять его в популяции кошек на значительно более ранних этапах, чем это можно делать с помощью УЗИ, например, у котят чуть старше месячного возраста.
Научная основа генетического метода выявления АДППК следующая. Точечная мутация (трансверсия5 C—>A) в экзоне6 29 гена, названного PKD1 (polycystic kidney disease 1 (autosomal dominant)), как доказано, является обязательным условием для развития поликистоза почек у кошек. Поэтому выявление или, напротив, невыявление этой т.н. молекулярной диагностической единицы с помощью лабораторных методов диагностики (например, ПЦР) на сегодняшний день и стало доступным, а в некоторых странах и рутинным методом диагностики АДППК.
Анализ для отправки в авторитетную лабораторию берётся у пациента обычно путём взятия мазка из ротовой полости. А в случае котят, сосущих молоко, в составе которого находятся гены матери, способные повлиять на достоверность анализа, а также у возрастных животных для проведения точного анализа необходима кровь из вены7. Достоверность диагностики этими методами на сегодняшний день составляет 98-99,9% .
Проведение теста на АДППК, равно как и на вирусную лейкемию и вирусный иммунодефицит, является обязательным исследованием перед продажей и вязкой кошек (прежде всего попадающих в группу риска по породной принадлежности). И особенно важно это в случае племенных животных. В некоторых странах (ЕС, США) существуют общедоступные базы данных с результатами исследования на АДППК. Информация, полученная при диагностическом исследовании, записывается в лицензированном ветеринарном учреждении на микрочип животного, а данные передаются в AD-PKD Negative Register8.
Для диагностики АДППК нежелательно использование выделительной урографии из-за риска реализации нефротоксичных эффектов рентгеноконтрастных веществ и угрозы значимого ухудшения почечной функции. Кроме того, контрастное вещество может депонироваться в почечных кистах и длительное время оказывать своё негативное влияние, в том числе и на неизменённую почечную ткань. Ретроградная же урография при поликистозе почек вообще противопоказана.
Также следует помнить, что наличие полостей в почке является категорическим противопоказанием к проведению пункционной и аспирационной биопсии. Кроме того, сами эти методы при поликистозе почек неоправданны (не информативны) с диагностической точки зрения.
Интересной особенностью течения доклинического этапа АДППК является то, что уровень эритропоэтина (из-за гиперпродукции его мозговым слоем почек) и, соответственно, Hb у больных животных значительно повышается. Поэтому полицитемия (появление в крови избыточного количества эритроцитов) может служить одним из косвенных признаков этого заболевания. На клиническом этапе эти показатели хотя и снижаются, но их величина никак не коррелирует с тяжестью структурных изменений в почечной паренхиме.
Напротив, при диабетической нефропатии уровень эритропоэтина у пациентов, как правило, значительно ниже того, который можно было бы ожидать, исходя из результатов лабораторных и визуальных методов диагностики.
Клинические проявления АДППК
Клинические проявления АДППК ничем не отличаются от таковых при ХБП, вызванной любой другой причиной, и не характеризуются какой-либо патогномоничностью. Исключением, как правило, на заключительных этапах течения АДППК, могут быть названы только характерные изменения размеров, структуры и контура почек, легко выявляемые при пальпации.
По большому счёту АДППК — это вариант ХБП с установленной первичной этиопатологической причиной, неотъемлемым маркером и фактором патогенеза которой является определённая генетическая патология. Поэтому в ветеринарной документации в разделе «окончательный диагноз» сначала отмечают АДППК, а затем — ХБП с указанием (по классификации IRIS9) степени ХПН по уровню креатинина, величины суточной протеинурии (по соотношению P/C U)10 и системной гипертензии.
АДППК является одним из классических примеров того, что для диагностики заболеваний почек ни в коем случае нельзя опираться только на уровень креатинина сыворотки крови. У животного с поликистозом его нормальный уровень может длительное время сохраняться (равно как и могут отсутствовать любые другие признаки нефропатии), но это никоим образом не говорит о том, что у пациента нет неизлечимой и смертельно опасной патологии.
Для АДППК характерны следующие изменения в результатах исследования биологических жидкостей, возникающие ещё на доклиническом этапе течения почечного континуума:
- снижение относительной плотности мочи (< 1030) и развитие полиурии, наиболее раннее проявление заболевания, свидетельствующее об ущемлении концентрационной функции почек вследствие атрофии и фиброза, преимущественно тубулоинтерстиция;
- микрогематурия наблюдается довольно часто и является следствием истончения и разрыва сосудов в стенках кист, в том числе в результате АГ; макрогематурия может возникнуть в основном при стрессовых состояниях, травмах или при осложнении поликистоза почечно- или мочекаменной болезнью;
- протеинурия, как правило, не достигает высоких значений (в пределах 0,3 г/л); но неуклонное её возрастание в течение короткого времени свидетельствует о высоком риске прогрессирования ХПН, ассоциированной с АДППК, поскольку, как и при любой другой форме ХБП, протеинурия — это не только маркёр, но и значимый фактор поражения почечной паренхимы (прежде всего тубуло-интерстициального аппарата).
Следует отметить, что все перечисленные изменения появляются намного раньше, чем у пациента развиваются какие-либо изменения в анализах крови.
Артериальная гипертензия (АГ) присутствует у большинства пациентов с АДППК ещё до развития у них клинических признаков ХПН и неуклонно прогрессирует с возрастом. Поскольку точное измерение давления крови у кошек связано с целым рядом трудностей, наиболее точным маркером хронизации гипертонической болезни служит патологический билатеральный мидриаз и напрямую связанные с ним характерные изменения на глазном дне (кровоизлияния в сетчатку, отслоение сетчатки, синдром извитых сосудов и «бычьих рогов» и т.д.).
Причиной развития АГ при АДППК служит гиперактивация ренин-ангиотензин-альдостероновой системы (РААС), возникающая в результате давления кист на сосуды почек и прежде всего на её первичную микрокапиллярную сеть (афферентные, эфферентные артериолы и капиллярные петли гломерулы). Гиперактивация РААС связана преимущественно с увеличением выработки ренина почками, в том числе и в атипичных для этого местах их паренхимы (в норме ренин вырабатывается только клетками юкстагломерулярного аппарата в стенках афферентных артериол клубочка в ответ на снижение кровяного давления и скорости клубочковой фильтрации). Ишемический компонент усугубляется другим звеном патогенеза АГ — задержкой натрия в организме, обусловленной генетически детерминированным увеличением его реабсорбции.
Итогом гиперактивации как тканевого, так и плазменного компонентов РААС и прогрессирования АГ при АДППК является поражение других органов-мишеней и прежде всего сердца. Кардиальная дисфункция в свою очередь усугубляет тяжесть АГ, что приводит к ещё большему поражению функционирующей почечной паренхимы. В итоге классический порочный круг ренально-кардиального и кардио-ренального синдромов замыкается.
Нефролитиаз может осложнять течение АДППК. Причинами повышенного образования мочевых камней обычно является нарушение в метаболизме и пассаже мочи по канальцам и собирательным трубочкам, а также застой содержимого в кистах.
Боль в брюшной полости, связанная с растяжением кистами капсулы почки и являющаяся частым клиническим признаком поликистоза почек у человека, не характерна для кошек. Поэтому использование обезболивающих препаратов при АДППК (особенно НПВП) является не только не рациональным, но и может значительно ухудшить почечную функцию из-за нефротоксичности, всем им присущей.
Клинические проявления АДППК появляются у животных только тогда, когда в состоянии деструкции оказывается не менее 75% ренальной паренхимы. Это характерно для ХБП в целом и связано с колоссальными компенсаторными возможностями почек. Поэтому, также как и при любом другом варианте ХБП, в течении АДППК выделяют доклинический (как правило, занимающий до 75-90% времени заболевания) и клинический (причем не обязательно азотемический) этапы почечного континуума.
Лечение АДППК
На сегодняшний день нет ни одного известного способа, позволяющего замедлить генетически обусловленный темп роста почечных кист. Также они не могут быть иссечены хирургическим путем. Ведётся дискуссия по поводу целесообразности декапсуляции почек при АДППК на заключительных его этапах, но убедительных доказательств эффективности этого мероприятия пока не получено. Также вызывает сомнения методика, предполагающая эвакуацию жидкости из кист с последующим введением туда растворов этилового спирта.
Но, разумеется, владельцев кошек, у которых, особенно в молодом возрасте, был диагностирован АДПП, интересует вопрос, можно ли отдалить время развития у их питомца клинических проявлений заболевания и смерти от терминальной стадии ХПН.
Да, определённые терапевтические тактики ведения пациентов с АДППК существуют. Причём следует отметить, что начинать агрессивную нефропротективную терапию следует на доклиническом этапе почечного континуума как можно в более ранние сроки. Только такой подход позволит максимально продлить продолжительность полноценной жизни пациента.
В медицине человека получены убедительные доказательства того, что размер и количество кист не определяют темп снижения почечной функции . А декомпрессия кист не только не предотвращает прогрессирование ХПН при АДППК, но и не приводит к снижению уровня АГ .
Прогрессирование ПН при поликистозе определяется прежде всего состоянием не изменённой кистами почечной ткани и напрямую зависит от темпа происходящих в ней склеротических изменений и скорости течения апоптоза. Кроме того, важную роль в ухудшении почечной функции играет АГ. Течение всех перечисленных процессов невозможно без гиперактивации РААС. Ключевой её нейрогормон — АГ II обладает не только выраженными вазоконстрикционными свойствами и приводит к повышению системного давления, но и инициирует и поддерживает процессы клеточной пролиферации (в том числе кардиомиоцитов и резидентных клеток клубочка) и склерозирования.
Поэтому важнейшими терапевтическими задачами на доклиническом этапе течения АДППК будет снижение уровня АГ и контроль гиперактивности РААС. И успешное их решение может помочь улучшить прогноз заболевания в целом и отдалить клинический этап почечного континуума в частности.
Из препаратов, контролирующих активность РААС на доклиническом этапе течения АДППК, возможно использование ингибиторов ангиотензин-превращающего фермента (иАПФ) и блокаторов рецепторов АГ II в средних терапевтических дозах, а также прямых ингибиторов ренина (Алискирен (Расилез, Риксила, табл. 150 и 300 мг); в дозе 4,5–9,5 мг/кг один раз в сутки длительно)11 или их сочетаний.
На клиническом этапе из-за того, что подавляющее число нефропротективных препаратов начинают приобретать выраженные нефротоксичные свойства (из-за элиминации и/или метаболизма почками), предпочтение отдается БРА телмисартану (Микардис, Прайтор, Semintra) в дозе 1–2 мг/кг один раз в день. Этот препарат не только способен эффективно контролировать активность вазоконстрикционного, пролиферативного и антидиуретического звеньев РААС (на вазодилатирующее, антипролиферативное и диуритические звенья РААС, в отличие от иАПФ, БРА не влияют), но и практически на 100% элиминируется из организма печенью. Последнее снижает его нефротоксичность, делает более предсказуемой фармакодинамику и фармакокинетику у пациентов с нефропатиями и позволяет его использовать даже у животных с тяжёлыми степенями ХПН .
Для контроля у пациентов с АДППК уровня АГ целесообразно назначение блокаторов кальциевых каналов. У кошек препаратом с доказанными гипотензивными свойствами является амлодипин (0,625 мг, а в случае стойкой или выраженной гипертенизии — 1,25 мг на кошку в сутки длительно). Хотя недигидропиридиновые представители этой группы (верапамил, дилтиазем) в дополнение к антигипертензивным свойствам обладают, по крайней мере с теоретической точки зрения, ещё и выраженными нефропротективными свойствами, значительно возрастающими при сочетанном их использовании с иАПФ и БРА.
В качестве препаратов второго ряда для лечения АГ при АДППК возможно назначение селективных 1-адреноблокаторов (атенолол и метопролол: внутрь 1–2 мг/кг массы тела 1–2 раза в сутки длительно). Перспективным для использования представляется также кардиоселективный липофильный 1-адреноблокатор III поколения с вазодилатирующими и антиангиальными свойствами — небиволол.
Нужно учитывать, что верапамил не следует назначать с 1-адреноблокаторами из-за взаимного усиления побочных эффектов (например, развития выраженной брадиаритмии). В остальном БКК, 1-адреноблокаторы и препараты, контролирующие гиперактивность РААС, взаимно дополняют эффекты друг друга. Также их сочетанное использование позволяет минимум в два раза снижать дозу каждого конкретного препарата и тем самым нивелировать часть присущих ему побочных эффектов.
Основанием для отмены препаратов, контролирующих гиперактивность РААС и уровень АГ (за исключением, возможно, телмисартана), является повышение уровня креатинина, калия и/или появление клинических признаков ХПН.
Контроль гиперфосфатемии и её необратимого последствия — гиперпаратиреоза (а гиперплазия паращитовидных желез, как известно, необратима и всегда приводит к стойкому повышению уровня паратиреоидного гормона (ПТГ) в организме) — также необходимо начинать на доклиническом этапе течения АДППК. Для этого следует рекомендовать пациентам как диетические продукты с низким содержанием фосфора, так и фосфат-байндеры (карбонат кальция + хитозан, лантаренол и т.д.12). Сложностью в контроле гиперфосфатемии является то, что у больных животных длительное время уровень фосфора может быть компенсирован повышенным уровнем ПТГ, способным длительное время форсировать выделение этого элемента из организма даже на фоне выраженного ущемления почечной функции (этот промежуток времени называется компенсированной гиперфосфатемией). Когда же и этот компенсаторный механизм перестаёт справляться со своей задачей, то уровень фосфатемии начинает стремительно нарастать. Кроме того, в последующем, на фоне гиперплазии паращитовидной железы, даже низкий уровень фосфора не приведёт к уменьшению её гиперактивности. Определение же уровня самого ПТГ представляет в ветеринарной медицине (во всяком случае в России) большие сложности из-за невозможности использования человеческих реактивов.
Поэтому уровень фосфора у животных с АДПП на доклинических этапах почечного континуума желательно поддерживать на нижних границах референсных значений. Только такой подход позволит отдалить накопление в организме одного из самых значимых уремических токсинов — паратиреоидного гормона.
Диуретики, в том числе петлевые, не снижают уровень АГ у животных с АДПП (в этом отношении их эффект невелик у животных и при АГ другого генеза). Кроме того, они (особенно петлевые и тиазидные) противопоказаны в связи с вероятностью усугубления нарушения транспорта натрия в канальцах и усиления тяжести полицитемии.
Длительное назначение НПВП (даже современных селективных ингибиторов ЦОГ-2) для купирования болевого синдрома любого генеза у животных с поликистозом почек противопоказано, поскольку способно привести к усугублению поражения тубулоинтерстиция и стремительному снижению почечной функции.
Инфицирование содержимого кист патогенами является довольно редким осложнением при АДППК и возможно в большинстве случаев только лимфо-гематогенным путём на фоне выраженных иммунодефицитных состояний (например, при тяжело протекающих вирусных инфекциях). Диагностика данного осложнения в обязательном порядке требует проведения бакпосева мочи, полученной чрезбрюшинным уроцистоцинтезом или, в некоторых случаях, непосредственно из кист.
Большой сложностью при лечении инфицированных кист является то, что антибиотики должны свободно в них проникать и затем накапливаться внутри. Этой способностью обладают только высоколипофильные антибактериальные препараты, например ципрофлоксацин. Вместе с тем большинство других антибиотиков, например, пенициллины и аминогликозиды, с трудом проникают в кисты, и поэтому назначение их нерационально, а в случае последних ещё и противопоказано из-за выраженных нефротоксичных свойств.
На клиническом этапе течения АДППК, т.е. у животных со значительно сниженной почечной функцией, возможна (как и при ХБП, имеющей любую другую этиологию) только заместительная и/или симптоматическая терапия (описание которой не является целью данной статьи, а сами рекомендации по этой теме без труда можно обнаружить в доступной литературе).
Уже по определению эта терапия далеко не всегда способна значимо улучшить качество жизни пациентов, даже при значительных затратах времени и материальных средств со стороны владельцев, поскольку приходится бороться с дисфункцией органа, выполняющего колоссальное число разнообразных экскреторных, инкреторных, метаболических и эндокринных функций. Кроме того, проведение интенсивных лечебных мероприятий часто приводит к развитию у кошек острого или хронического стресса, способного нивелировать усилия врачей даже в случае куда менее тяжёлых патологий, чем АДПП.
Следует отметить, что в гуманной медицине доказано, что, например, контроль гипертонии, начатый на фоне уже значительно сниженной почечной функции, не приводит к замедлению скорости прогрессирования ХПН, ассоциированной с АДПП человека .
В некоторых случаях у животных с АДПП для лечения болевого синдрома и/или хронического стресса, связанного с проведением лечебных мероприятий, целесообразно использование трициклических антидепрессантов, таких как амитриптилин, имипрамин или кломипрамин13. Вид препарата, а также его доза и продолжительность использования подбираются индивидуально в зависимости от потребностей и индивидуальной чувствительности пациента.
Прогноз
Прогноз у животных, больных поликистозом почек, определяется темпом прогрессирования ХПН, который может быть особенно велик у кошек:
- первые клинические проявления заболевания у которых появились в молодом возрасте;
- имеющих в анамнезе неконтролируемую АГ, эпизоды макрогематурии и рецидивирующие (хронические) бактериальные инфекции МВС;
- перенёсших острые и/или болеющих хроническими и/или латентными формами вирусных инфекций (эти патологии всегда сопровождаются образованием ЦИК14, воздействие которых на фильтрационный барьер гломерулы у кошек часто приводит к интенсивному аутоиммунному воспалению и развитию различных форм гломерулонефритов).
Примечания
1 Англ.: Feline autosomal-dominant polycystic kidney disease (ADPKD).
2 Аутосома — парная неполовая хромосома, одинаковая для мужских и женских организмов.
3 Доминантный ген поликистозной болезни почек-1 (англ.: Polycystic Kidney Disease-1). PKD2 — рецессивный ген поликистозной болезни почек, вызывает это заболевание только у человека.
4 Иными словами, у всех кошек, поскольку нефропатии у этого вида животных на сегодняшний день приобрели во всем мире масштаб пандемии неинфекционного характера.
5 Трансверсия (transversion) — тип мутации в ДНК или РНК, приводящий к замене пуринового основания на пиримидиновое или наоборот.
6 Экзон — участок гена (ДНК) эукариот, несущий генетическую информацию, кодирующую синтез продукта гена (белка).
7 Собственно говоря, кровь может использоваться для диагностики АДППК у животных любого возраста, и ограничения в этом случае связаны только с тем, что венепункция сопряжена для пациента с большим стрессом, чем мазок из ротовой полости.
8 International Cat Care: отрицательный реестр по АДППК (http://www.icatcare.org:8080/search/gss/PKD).
9 http://www.iris-kidney.com
10 Уровень суточной протеинурии определяется у животных по соотношению белок мочи/креатинин мочи (определённых в идентичных величинах).
11 Прямые ингибиторы ренина, во всяком случае с теоретической точки зрения, при АДППК должны обладать самыми высокими нефропротективными свойствами из всех групп препаратов, контролирующих активность РААС. Связано это с тем, что гиперпродукция ренина, в том числе в атипичных для этого участках почечной паренхимы, является начальным звеном в развитии АГ при поликистозе.
12 Использование в качестве фосфат-байндеров солей алюминия ограничено их высокой токсичностью.
13 Трициклические антидепрессанты обладают помимо тимоаналептического (антидепрессивного) и анксиолитического (противотревожного, транквилизирующего) действия также центральным обезболивающим, седативным, снотворным и антигистаминным эффектами.
14 АГ+АТ+С3
Литература
4. Cannon M, Barr F: Screening for polycystic kidney disease in cats. Vet Rec 147: 639–640, 2000.
5. Cannon, M.J., et al. (2001). Prevalence of polycystic kidney disease in Persian cats in the United Kingdom. Vet Rec 149: 409–411.
6. Cooper B: Autosomal dominant polycystic kidney disease in Persian cats. Feline Prac 28: 20–21, 2000.
17. Lyons, L.A., et al. (2004). Feline polycystic kidney disease mutation identified in PKD1. J Am Soc Nephrol 15: 2548–2555.
Поликистоз почек у кошки
Здравствуйте! Последнее время кошка очень много пьет жидкости и много ходит в туалет, причем моча практически без запаха. Сильно похудела, на днях пропал аппетит, всё время лежит. При ощупывании обнаружила две опухоли, после УЗИ выяснилось, что у кошки поликистоз обеих почек. Размеры почек: правая — 86 х 42 мм, левая — 63 х 39 мм. Проблемы с почками уже были (мочилась часто и по чуть-чуть), но всё проходило после приема «Здоровых почек» («Фитоэлита»). Знаю, что кошку уже не спасти и если будет ухудшение, то избавим её от мук усыплением. Пробуем сейчас облегчить её состояние. В ветеринарной поликлинике ставили капельницу: рингер 200,0 мл, фуросемид 0,5 мл, и ещё какой-то препарат 1,0 мл, не разберу названия (то ли лоторол, то ли котофол). В/м поставили тиатриазолин и но-шпу. Дома даём опять-таки «Здоровые почки» и «Котэрвин». Начнем давать плантекс. Кошке 7,5 лет, читала, что с поликистозом кошки редко живут дольше. Но, надежда умирает последней…
Прошу совета по поводу кормления кошки, что лучше давать, а что исключить из рациона. Сейчас из еды ест (насильно) сырые перепелиные яйца (это ветеринар посоветовала), кефир.
И очень волнует вопрос, насколько болезненно это заболевание и его последствия для кошки. Мучить её совсем не хочется….
Диагностика
Явные болезненные симптомы обычно указывают на то, что уже начала развиваться почечная недостаточность. Поэтому ветеринар, скорее всего, проведет диагностические обследования с упором на мочевыделительную систему. В первую очередь проводится полный анализ крови, в том числе и биохимический профиль. Поскольку почки отфильтровывают токсины из крови (которые затем выводятся с уриной), то расширенный анализ мочи также является эффективным методом диагностики. После того как предварительный диагноз будет подтвержден, ветеринар даст направление на рентгенографическое и ультразвуковое обследование. Рентген позволит точно оценить размер и локализацию кист.
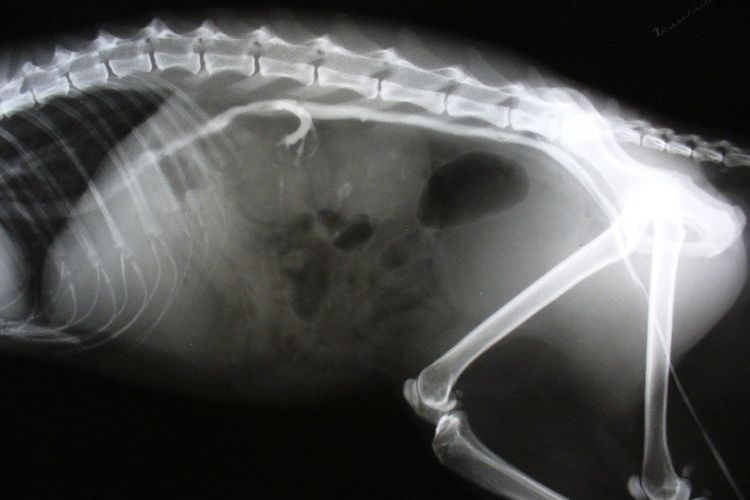
УЗИ — точный и сравнительно недорогой метод диагностики поликистоза, который подходит для обследования взрослых животных. У котят возрастом до девяти месяцев кисты могут быть не видны.
Если есть подозрения, что котенку мог быть передан дефектный ген ПБП, не стоит дожидаться, пока животное вырастет. Достаточно заказать проведение ДНК-тестирования в специализированной ветеринарной лаборатории.
Лечение
Медикаментозное лечение поликистоза почек у кошек обычно прописывается уже после диагностики почечной недостаточности. Сначала животному подкожно вводится физиологическая жидкость для предотвращения обезвоживания. Затем питомцу на постоянной основе придется принимать фосфат-связывающие препараты (карбонат или цитрат кальция). Дело в том, что поврежденные ткани не могут нормально удалить фосфор из крови. Это приводит к тому, что уровень фосфора в организме становится слишком высоким. А постоянно повышенный уровень фосфора в крови может привести к тому, что организм начнет терять кальций, и животное может дополнительно заболеть остеопорозом. Если почечная недостаточность привела к гипертонии (постоянно высокому кровяному давлению), то назначаются антагонисты кальция.
Внимание! Давать кошке с почечной недостаточностью мочегонные препараты для снижения давления категорически запрещено!
Также, животным с ПБП очень часто прописывается синтетический эритропоэтин. У здорового животного данный гормон (отвечающий за регулировку выработки эритроцитов) производят почки. Но как только здоровая ткань замещается кистозной более чем на 50%, сигналы о необходимости выработки эритроцитов перестают доходить в костный мозг. В итоге, клинические анализы крови больного животного показывают низкое количество эритроцитов.
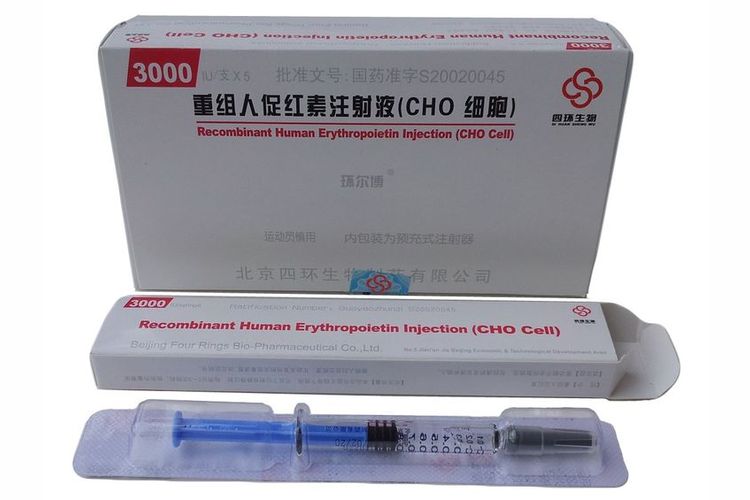
Важная информация! На данный момент в аптеках нет ветеринарной формы эритропоэтина, поэтому котам приходится давать препарат, разработанный для людей. Такая замена чревата тем, что организм некоторых животных может в конечном итоге распознать синтетическое гормональное вещество как чужеродное.
Важная информация для хозяина
Поликистозная болезнь почек, к сожалению, неизлечима. На данный момент нет никакого реального способа замедлить рост кист. Также нельзя удалить, или проткнуть пузырьки с жидкостью. Поэтому хозяин должен направить максимум усилий на обеспечение безболезненной и комфортной жизни любимца.
Чтобы понять, как именно помогать питомцу со страшным диагнозом, необходимо разобраться с механизмом работы почек. Жизненно важный парный орган помогает контролировать кровяное давление, выделяя уникальный фермент под названием ренин. Когда кровяное давление падает (а органы при этом не получают достаточного количества крови) ренин высвобождается, заставляя кровеносные сосуды сузиться. Как только кровеносные сосуды сузятся, кровяное давление вырастет. Здоровые почки отфильтровывают токсины и избыток воды из крови. Очищенная кровь остается в организме, а отходы покидают тело вместе с мочой. Также почки помогают поддерживать надлежащий баланс витаминов и минералов в крови, включая натрий, кальций, калий и магний. Но по мере того как кисты будут разрастаться, все вышеперечисленные функции почек значительно ухудшатся.
Поэтому важно снизить уровень токсинов в организме кошки. Нужно убедиться, что питомец не контактирует с больными питомцами, питается простыми, но питательными продуктами, а также привит от самых распространенных инфекционных заболеваний. Обязательно нужно следить за тем, чтобы в рационе животного были продукты с низким содержанием белка и фосфора. Конечно же кошки нуждаются в протеине для нормального роста, наращивания мышц и быстрого восстановления поврежденных тканей. Но после того, как организм переработает поступивший белок, образуется отход под названием мочевина. Коты с почечной недостаточностью не могут быстро и без последствий полностью избавиться от данного продукта переработки.